

作者: 高建军,段宏
耳硬化症(otosclerosis,OTSC)是一种相对常见的听力障碍原因,成人传导性听力损失的主要形式,其特征是中耳和内耳骨重塑,致密骨组织的交替吸收,被耳囊内的海绵组织取代,导致镫骨足板到前庭窗的声波传导受损引起的听力下降。
耳硬化症的显性遗传性已被证实,这种显性遗传不完全外显率(即个体虽然携带了导致某种疾病的基因,但并不表现出该疾病的症状)为25%~40%。尽管临床上有显性遗传的家族性耳硬化症病例,但是大部分病例并没有遵守孟德尔遗传定律,近40%~50%的病例是缺乏家族史的散发病例。这主要是因为外显率减少、除了显性遗传的其他遗传模式因素、新的突变、表型复制或是复杂因素或者由多因素引起的由遗传因素和环境因素等共同作用导致的耳硬化症。
大量研究证实了多种环境和遗传因素对于耳硬化症的病理生理学影响。遗传因素通过分子途径在耳硬化症的发展中起作用,包括骨质重建、免疫学途径、炎性途径和内分泌途径。本文旨在总结已经被证实在耳硬化症发展中起作用的遗传学和分子生物学机制。
一、环境因素
1.1 麻疹病毒感染
关于麻疹病毒感染在耳硬化发病机制中的潜在作用研究,先是在耳海绵组织标本的成骨细胞中发现了类似麻疹病毒核衣壳的丝状结构,随后一些研究支持了麻疹病毒感染与耳硬化症发生相关假设:包括在电子显微镜下鉴定麻疹病毒结构、使用免疫组化鉴定麻疹病毒蛋白、使用逆转录聚合酶链反应鉴定耳硬化组织中的麻疹病毒RNA(ribonucleic acid),以及在耳硬化患者的外淋巴和血清中发现高浓度的抗麻疹病毒免疫球蛋白G。耳硬化镫骨足板(从镫骨切除术取得的标本)经透射电镜研究发现,在成骨细胞和前成骨细胞的粗面内质网和胞液里存在的丝状结构与麻疹病毒的核壳体无差异。免疫组织化学和分子生物学研究表明,在活动期耳硬化病灶中有麻疹核苷酸存在。此外,麻疹病毒显示出对耳囊的高亲和力,这可能解释了为什么耳硬化改变只发生在这个位置。此前的研究显示,耳硬化镫骨足板中CD46受体基因的新剪接变异,证明麻疹病毒感染、CD46受体和耳硬化症之间的潜在联系。尽管有证据表明慢性麻疹病毒感染在耳硬化症的发病机制中,但麻疹病毒在疾病发展中的作用仍存在争议。
1.2 氟化钠
氟化钠被认为可抑制蛋白水解酶,稳定病理性增加的骨转换。氟化钠抑制硫酸转运蛋白(diastrophic dysplasia sulfate transporter,DTDST),通过参与骨基质粘多糖的硫酸化在骨转换中起主要作用,并被发现在耳硬化镫骨中活性加强。DTDST活性升高与感音神经性聋相关;因此,抑制它可防止听力恶化。虽然耳硬化症与饮用含氟水之间的联系已经得到证实,且补充氟化钠治疗的有益效果也得到证实,但这些发现在各项研究中并不一致。最近一项系统综述评价了氟化钠对耳硬化症听力恶化的影响,结论是氟化钠对耳硬化症患者的有效性证据有限。
二、耳硬化症的遗传学
耳硬化症被广泛认为是一种复杂的多因素疾病,其病因涉及遗传和环境等因素。在50%~60%的患者中,以家族形式存在。在大多数家族中,耳硬化症似乎是由少数遗传因素(寡基因)引起的,只有在少数家族中这种疾病似乎是真正的单基因。在其余患者中,存在复杂的遗传形式的耳硬化。一些研究旨在确定耳硬化的遗传因素,导致鉴定了8个已发表的单基因耳硬化位点,以及几个基因和1个染色体区域(11q13)与耳硬化有明显关联。在耳硬化研究中实施二代测序(next-generation sequencing,NGS)已经鉴定出MEPE、ACAN和SERPINF1的致病变异,尽管后者的致病作用仍存在争议。此外,最近的一项全基因组关联研究(genome-wide association studies,GWAS)可被认为是耳硬化症的一个突破,它确定了几个与耳硬化症密切相关的基因,并提出了新的潜在候选基因。这些发现对揭示耳硬化的遗传结构很重要。未来更多的研究将有助于了解该疾病的完整发病机制。本文综述利用基因关联研究和基因表达分析研究的几种基因和分子通路。这些基因和分子通路在骨代谢、免疫系统、炎症和内分泌系统中均有作用。
2.1 骨代谢改变
2.1.1 I型胶原
编码I型胶原α-链的基因COL1A1和COL1A2突变会导致成骨不全、骨质疏松,大多数成骨不全患者逐渐发展为严重的听力损失,类似于耳硬化-听力损失表现。局部I型胶原合成减少对听小骨的破坏可能也是导致耳硬化症的病理学改变。耳硬化症的发生是一个复杂的过程,单个COL1A1的多态性改变并非导致耳硬化的唯一因素,可能需要筛选多个候选基因,研究其相互作用。于慧前等通过家系研究发现Van der Hoeve综合征中的COL1A1突变分别是位于外显子26的c.1792C>T突变和外显子43的c.3076C>T突变,这可能与成骨不全、蓝巩膜以及传导性耳聋的发生相关。通过该家系分析得出,COL1A1基因c.3540delC突变导致的I型成骨不全/耳硬化症为非综合征型、常染色体显性遗传,临床表型较轻,对进一步研究I型成骨不全/耳硬化症的临床表型和致病机制具有重要意义。
2.1.2 耳囊骨质重塑和耳硬化症
耳囊由骨内膜层、内生软骨层和骨外膜层组成,并在胎儿发育过程中通过软骨内成骨过程产生,该过程包括软骨结构的初始形成,随后被骨取代。骨重塑由破骨细胞骨吸收和成骨细胞骨沉积的平衡过程组成,受到一组细胞因子的密切调控,包括骨保护蛋白(osteoprotegerin,OPG)、核因子κB受体激活剂(receptor activator of nuclear factor kappa B,RANK)、RANK配体(receptor activator of nuclear factor kappa B ligand,RANKL)以及转化生长因子β1(transforming growth factor beta 1,TGF-β1)。OPG是肿瘤坏死因子(tumor necrosis factor,TNF)受体超家族成员11B (TNFRSF11B)基因编码的一种针对RANKL的诱导受体。RANKL与RANK结合,导致破骨细胞成熟和骨吸收,与OPG结合,以调节这一过程。骨形成蛋白-2(bone morphogenetic protein 2,BMP2)和骨形成蛋白-4(bone morphogenetic protein 4,BMP4)是具有显著相关性的2个基因。也是TGF-β细胞因子家族的成员。在耳硬化症的背景下,骨重塑的失调仅发生在耳囊内,引起耳硬化症病灶,多起自内生软骨层,蔓延至前庭窗,固定镫骨,并使鼓室骨膜增厚。可到达前庭半规管和耳蜗的骨内膜,造成耳蜗血供的异常分流。虽然已有大量研究旨在确定引发耳囊内骨转换失调的因素,但对这一过程仍知之甚少。也许对耳囊胚胎发生以及耳囊内正常骨重塑的进一步了解将为耳硬化症的发病机制提供更多线索。
2.2 免疫系统的角色
组织相容性位点抗原(histoeompatibility locus antigen,HLA)是人类的主要组织相容性复合体(major histoeompability complex,MHC)的代表,具有多态性遗传物质之一的HLA通过向T细胞呈递抗原、调控免疫细胞从而在免疫应答中发挥重要作用。耳硬化患者中HLA-A9、A11和B13的效价相较于正常人群偏高,提示耳硬化症患者HLA相关成分的遗传。虽然耳硬化症与某些HLA抗原之间的相关性已被报道,但这种相关性在各种研究中并不一致或可重复。需要进一步研究证实HLA抗原和耳硬化症之间的联系。
2.3 炎症
2.3.1 炎性细胞因子
炎症细胞因子与耳硬化症的发病有关。在研究的炎症因子中,肿瘤坏死因子α(TNF-α)和TNF-α受体与耳硬化的组织活性相关,在耳硬化症的活动期表达增加。TNF-α已被证明可以促进骨吸收,并可能是耳硬化症中骨代谢失调的催化剂。TNF-α表达的增加也是耳硬化症感音神经性聋的潜在促进因素。除了TNF-α外,调节促炎细胞因子产生的血管紧张素II也被认为是耳硬化炎症途径和异常骨重塑的关键因素。
2.3.2 氧化应激
氧化应激和活性氧有可能影响几种细胞信号通路,并可能在耳硬化的病理生理学中发挥重要作用。一项研究通过对耳硬化骨和对照镫骨中4-羟基壬烯醛(4-Hydroxynonenal,HNE)蛋白复合物的免疫组化研究氧化应激在耳硬化发展中参与的可能性。HNE是脂质过氧化的主要生物活性标记物,并作为自由基的第二信使。虽然两种样本中均存在HNE蛋白复合物,但在耳硬化样本的病理骨形成区,HNE蛋白加合物多焦点区域的分布有显著差异。HNE蛋白加合物仅存在于对照样本的骨膜区域。该研究证实HNE和血管紧张素II对骨细胞增殖、分化和凋亡的调节作用,进一步支持了其在耳硬化发病机制中的潜在作用。除了炎症细胞因子外,氧化应激和活性氧也与其他形式的听力损失,并可能在与耳硬化症相关的感音神经性听力损失中发挥作用。
2.4 内分泌系统的作用
2.4.1 雌激素
耳硬化症组织中表达的受体类型转变可能介导雌激素对耳硬化症发展和异常骨重塑的潜在影响。雌激素能促进催乳素的释放,而催乳素可降低OPG,增加RANKL,影响骨代谢。
2.4.2 肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)
血管紧张素II通过与各种生长因子和细胞因子的相互作用参与炎症和骨重塑过程。此外,血管紧张素II仅在耳硬化细胞中增加白细胞介素-6的体外分泌,并降低碱性磷酸酶的活性,表明血管紧张素II在骨重塑失调和耳硬化发展中的作用。
2.4.3 甲状旁腺激素及甲状旁腺激素相关受体表达
在耳硬化镫骨细胞培养中,需要较高的甲状旁腺浓度刺激腺苷酸环化酶活性,同时较低的甲状旁腺相关受体mRNA表达与较低的cAMP反应相关。提示甲状旁腺激素的异常反应可能是耳硬化症骨转换异常的原因。
2.4.4 维生素D受体
经过对维生素D受体基因(vitamin D receptor,VDR)的4种多态性进行基因分型,其中3种与耳硬化有关。由于没有在更大的队列中进行关联复制,因此就VDR在耳硬化中的作用仍待进一步深入研究。
三、耳硬化症的单基因形式
在家族性单基因耳硬化症病例中已鉴定出8个已知染色体位点(OTSC1-5、OTSC7、OTSC8和OTSC10,另外,OTSC6、OTSC9已被人类基因组组织保留但尚未发表),见表1。
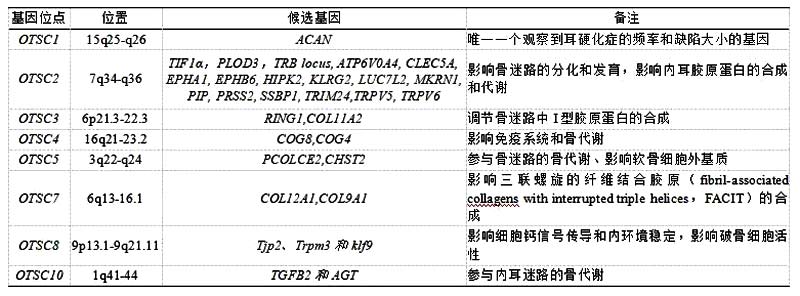
表1 耳硬化症单基因形式的8个已知染色体位点
四、其他潜在的贡献基因和分子途径
近年来,二代测序技术(NGS)以其便捷先进的彻底改变了基因组学和分子生物学。许多关于发现新的基因突变的报道,包括涉及罕见孟德尔疾病和常见复杂性状的基因突变。NGS已成功应用于识别多种疾病中的致病突变,导致与耳硬化症有关的3个新基因的识别。
4.1 SERPINF1编码色素上皮生长因子
一种有效的血管生成抑制剂和已知的骨重塑调节器,SERPINF1的功能突变导致色素上皮因子缺失,随后导致成骨不全症。血管生成先前被认为是临床耳硬化症的一个关键特征,在临床耳硬化症患者的多普勒血流测量中,伴有施瓦茨征和鼓岬血流量升高。其中serinf1-012被证明是人类镫骨的主要转录本,其在异质耳硬化镫骨样本中表达减少。此外,SERPINF1基因突变可导致一种罕见的VI型成骨不全症,这是另一种骨重塑和代谢障碍。
4.2 MEPE基因
在个别耳硬化患者中存在杂合子移码和无义变异,这种突变是相对罕见但高致病性的变异。此外,突变负荷测试还表明,这种突变从统计学角度看多发生在耳硬化症人群中。同时MEPE之间的关联在一项关于耳硬化症的全基因组关联研究(genome-wide association studies,GWAS)分析中得到了重复。
4.3 ACAN基因
编码黏多糖蛋白,该蛋白对软骨功能和骨骼发育至关重要。ACAN的显著变异谱是耳硬化症的一个突破,且到目前为止,是唯一1个观察到耳硬化症的频率和缺陷大小的基因。最近的一项全基因组关联研究(GWAS)确定了耳硬化症与编码络丝蛋白(reelin,RELN)的基因显著关联。RELN是一种已知在大脑发育和突触可塑性中起作用的细胞外基质蛋白。这种关联在具有等位基因异质性的多个人群中得到证实。RELN存在于人镫骨细胞培养物和小鼠内耳中,但其在这些组织中的功能以及在耳硬化发病机制中的作用尚不清楚。在目前的研究中,耳硬化症组织中RELN mRNA和reelin蛋白表达的减少,导致信号传导异常可能在耳硬化症的致病过程中发挥重要作用。RELN中罕见变异rs74503667对OTSC单基因形式的病因有很大影响,而rs3914132与该疾病的复杂形式相关。RELN、极低密度脂蛋白受体(very low density lipoprotein receptor,VLDLR)和脂蛋白受体相关蛋白8(lipoprotein receptor 8,LRP8)在耳硬化镫骨中的定量表达可能有助于理解异常骨生长中reelin蛋白的传导机制。然而,还需要更多的研究阐明reelin在镫骨周围异常骨生长中的确切作用。
五、结语
尽管对于耳硬化症的发展环境和遗传因素认识在逐渐加深,但对疾病发展的理解仍不清楚,且人们对导致这种疾病的环境和遗传因素知之甚少。与其他遗传疾病不同的是,基因连锁分析、定位克隆和全基因组关联分析使我们识别了许多致病基因,但耳硬化症的遗传学在很大程度上仍未被确定。GWAS帮助我们鉴定了多个新的基因位点,可用于鉴定新的致病基因,为病理生理学提供了新的见解。这些新关联的识别可通过NGS放大到候选基因,以寻找致病变异。无论是在耳硬化症家族还是在散发性患者群体中,使用GWAS鉴定的新基因有助于进一步研究耳硬化症的单基因和复杂形式。构建耳硬化症的动物模型是研究耳硬化症致病机制以及相关致病基因的有效途径。近年来,针对耳硬化症致病基因的动物学研究相对较少,耳硬化症的具体分子作用机制尚需深入研究。基因治疗是指将正常功能的基因或有治疗作用的基因通过一定方式导入靶细胞内,以纠正、替代基因缺陷或异常,实现治疗疾病的方法。耳聋的基因治疗也是针对临床前动物模型筛选出已明确的致聋基因,研发有效的基因治疗策略。目前国内外已开展遗传性耳聋基因治疗临床转化,且完成多例耳聋患者基因治疗,安全性和治疗效果得到肯定。
综上,笔者认为GWAS、靶向NGS结合表观遗传学的改变,有助于增加对耳硬化症发病机制的遗传学和分子生物学认识。在此基础上通过建立耳硬化症动物模型,进一步验证明确致病基因,为后续基因治疗提供可行性将是进一步研究和努力的方向。
厦门助听器哪家好?厦门助听器-益耳助听器中心,真正近30年专业经验助听器验配,亲手验配5千名用户,世界六大品牌助听器,自有店面稳定经营厦门助听器专卖店,助您回归精彩有声世界。
相关阅读:耳硬化症全面解读